肿瘤治疗长期面临疗效有限和复发风险高的难题。化疗、放疗等传统手段虽然改善了患者预后,但因毒副作用和耐药性常常难以达到理想效果。光热治疗(PTT)凭借近红外光的深部穿透和高精度消融能力,被认为是一种具有前景的微创方案,但在实际应用中仍存在药物在肿瘤组织累积不足、热分布不均匀等问题。与此同时,利用纳米酶在肿瘤微环境中催化产生活性氧,推动化学动力学治疗(CDT)和铁死亡的研究不断发展。如何将光热治疗与催化疗法有效结合,并兼顾实时影像监测,成为精准医学领域亟待突破的关键问题。
针对这一挑战,陈策实团队朱曦博士构建了具有“光热级联”特性的 IrOx-P 纳米酶,实现了外源光热触发与内源催化反应的双重响应。该纳米酶以氧化铱为核心,既能高效产热又具备氧化还原催化活性,并通过修饰 P-选择素靶向肽,实现对肿瘤的精准识别。静脉给药后,IrOx-P首先依靠肿瘤的高通透性进入病灶区域;在近红外光照下,纳米酶产生局部热效应,不仅直接杀伤肿瘤细胞,还能引发血管轻度损伤和血小板激活,从而促进更多纳米酶再次聚集于肿瘤,形成自我强化的“级联”效应。同时,在肿瘤的酸性和过氧化氢丰富的环境中,IrOx-P 通过Ir3+/Ir4+循环反应显著增强催化效率,持续产生活性氧并耗竭谷胱甘肽,诱导脂质过氧化和铁死亡。外源光热激活与内源催化反应的协同作用,带来了更强的抑瘤效果。动物实验结果证实,该策略能显著抑制肿瘤生长。更重要的是,IrOx-P 还具备优异的光声成像性能,通过催化产氧增强信号,实现了治疗过程的实时监测,为诊疗一体化提供了有力支持。
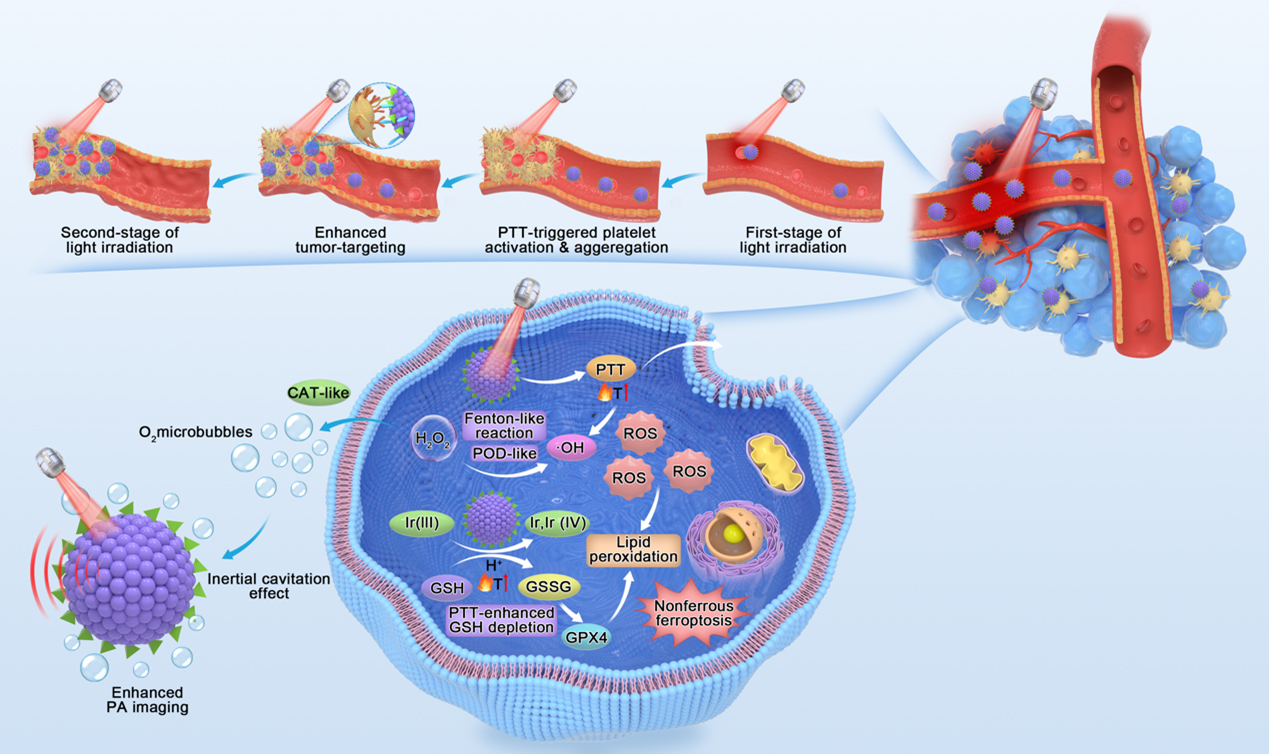
图1 IrOx-P纳米酶的多模态诊疗机制。光热照射会在肿瘤部位引起血管内皮损伤,从而触发活化血小板的募集。这些活化的血小板高表达 P-选择素,使其能够与修饰在 IrOx-P纳米颗粒表面的 PSN 特异性结合。该作用促进了 IrOx-P在照射部位的二次富集,从而增强了局部累积效果并提升后续治疗效能。
本研究提出的光热级联纳米酶策略,将光热治疗、化学动力学治疗、铁死亡诱导与光声成像有机结合,突破了单一疗法的局限,实现了治疗与监测的协同放大。该成果不仅展示了纳米医学在肿瘤精准治疗中的巨大潜力,也为未来诊疗一体化技术的临床转化提供了新思路。研究团队将继续优化这一平台,探索其在多种肿瘤模型中的应用前景。
该研究成果以“Self-enriching nanozyme with photothermal-cascade amplification for tumor microenvironment-responsive synergistic therapy and enhanced photoacoustic imaging”为题,于 2025 年 8 月23日在线发表于Materials Today Bio(一区TOP,IF = 10.2)。bat365在线平台生物医学工程研究院讲师朱曦、山东第一医科大学附属省立医院超声科副研究员张杨、bat365在线平台基础医学院本科生何昱菲为论文共同第一作者。bat365在线平台生物医学工程研究院陈策实研究员为论文通讯作者。该项研究得到国家自然科学基金委、国家重点研发计划项目、云南省科技厅等项目的资助。此外,该研究成果也于2025年5月16日获得国家发明专利授权。


